La termodinámica, por definirla de una manera muy simple, fija su atención en el interior de los sistemas físicos, en los intercambios de energía en forma de calor que se llevan a cabo entre un sistema y otro y tiene sus propias leyes.
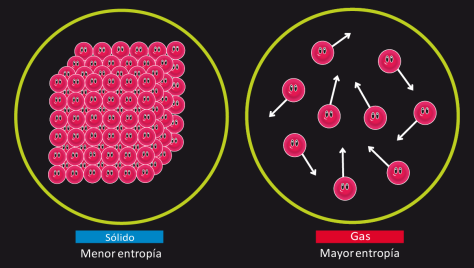
Uno de los soportes fundamentales de la Segunda Ley de la Termodinámica es la función denominada entropía que sirve para medir el grado de desorden dentro de un proceso y permite distinguir la energía útil, que es la que se convierte en su totalidad en trabajo, de la inútil, que se pierde en el medio ambiente.
La segunda ley de la termodinámica fue enunciada por S. Carnot en 1824. Se puede enunciar de muchas formas, pero una sencilla y precisa es la siguiente:
“La evolución espontánea de un sistema aislado se traduce siempre en un aumento de su entropía.”
La palabra entropía fue utilizada por Clausius en 1850 para calificar el grado de desorden de un sistema. Por tanto la segunda ley de la termodinámica está diciendo que los sistemas aislados tienden al desorden, a la entropía.
entropia

Abajo, aumenta la entropía.
Este desorden se grafica en la mayor o menor producción de energía disponible o no disponible, y sobre esta base, también podemos definir la entropía como el índice de la cantidad de energía no disponible en un sistema termodinámico dado en un momento de su evolución.
Según esta definición, en termodinámica hay que distinguir entre energía disponible o libre, que puede ser transformada en trabajo y energía no disponible o limitada, que no puede ser transformada en él.
Para comprender conceptualmente lo dicho, analicemos el ejemplo de un reloj de arena, que es un sistema cerrado en el que no entra ni sale arena.
La cantidad de arena en el reloj es constante; la arena ni se crea ni se destruye en ese reloj. Esta es la analogía de la primera ley de la termodinámica: no hay creación ni destrucción de la materia-energía.
Aunque la cantidad de arena en el reloj es constante, su distribución cualitativa está constantemente cambiando: la cavidad inferior se va llenando, mientras la cavidad superior se vacía. Esta es la analogía de la segunda ley de la termodinámica, en la que la entropía (que es la arena de la cavidad inferior) aumenta constantemente.
La arena de la cavidad superior (la menor entropía) es capaz de hacer un trabajo mientras cae, como el agua en la parte superior de una catarata. La arena en la cavidad inferior (alta entropía) ha agotado su capacidad de realizar un trabajo. El reloj de arena no puede darse la vuelta: la energía gastada no puede reciclarse, a menos que se emplee más energía en ese reciclaje que la que será desarrollada por la cantidad reciclada.
También podemos hacer el análisis tomando como ejemplo una cadena trófica.
La entropía acabará con el Universo.

En las cadenas tróficas al ir subiendo de nivel (de productores a consumidores) se va perdiendo energía química potencial. A medida que subimos en los niveles de la cadena, el contenido total de este tipo de energía es menor pero va aumentando la liberación de otro tipo de energía: El calor. Este último es un tipo de energía con menor probabilidad de aprovecharse ya que podemos generar menos trabajo con este tipo de energía que con la energía química potencial.
Al proceso por el cual la energía pierde su capacidad de generar trabajo útil o, mejor dicho, se transforma en otra energía que es menos aprovechable, se le llama entropía.
Mirado desde otro punto de vista, y para una comprensión y aplicación más general del concepto, la entropía se entiende como el grado de desorden de un sistema, así, por ejemplo, en la medida en que vamos subiendo niveles en la cadena trófica, cada vez tenemos menos control sobre la energía química potencial que sirve para generar trabajo ya que ésta se ha ido transformando en calor y nosotros podemos aprovechar (controlar) menos este tipo de energía, es decir va aumentando el grado de descontrol (desorden) que tenemos sobre la cadena trófica.
Por eso se dice que todo sistema biológico tiende a la entropía; es decir, al desorden.
Como podemos apreciar, la entropía es el elemento esencial que aporta la termodinámica, ciencia de los procesos irreversibles, es decir orientados en el tiempo.
Fragmentos de plato con alta entropía.

Ejemplos de procesos irreversibles pueden ser: la descomposición radioactiva, la fricción o la viscosidad que modera el movimiento de un fluido. Todos estos procesos poseen una dirección privilegiada en el tiempo, en contraste con los procesos reversibles.
Precisamente, la distinción entre procesos reversibles e irreversibles la introduce en termodinámica el concepto de entropía, que Clausius asocia ya en 1865 al “segundo principio de la termodinámica”.
Todos hemos visto alguna vez un plato que se cae desde una mesa y se hace añicos contra el suelo. Lo que antes estaba ordenado en una única pieza de porcelana, se convierte en una multitud de fragmentos desordenados. Pero la situación contraria, la recomposición de un plato a partir de sus fragmentos de manera espontánea, al menos que se sepa, no la ha visto nadie.
La ruptura del plato es un suceso natural e irreversible, una secuencia temporal adecuada; su recomposición, en cambio, no lo es. Es la evolución natural del orden al desorden o, en términos científicos, la natural tendencia del Universo a aumentar su entropía.
Todos tenemos una cierta idea, intuitiva, de lo que significa orden y desorden, pero desconocemos que el paso de una situación a la otra implica, de forma indefectible, el final de todo movimiento, la muerte del Universo.
Caracteristicas asociadas a la entropia.
-La entropia se define solamente para estados de equilibrio.
-Solamente pueden calcularse variaciones de entropia. En muchos problemas practicos como el diseno de una maquina de vapor , consideramos unicamente diferencias de entropia. Por conveniencia se considera nula la entropia de una sustancia en algunestado de referencia conveniente. Asi se calculan las tablas de vapor, e donde se supone cero la entropia del agua cuando se encuentra en fase liquida a 0’C y presion de 1 atm.
-La entropia de un sistema en estado se equilibrio es unicamente funcion del estado del sistema, y es independiente de su historia pasada. La entropia puede calcularse como una funcion de las variables termodinamicas del sistema, tales como la presion y la temperatura o la presion y el volumen.
-La entropia en un sistema aislado aumenta cuando el sistema experimenta un cambio irreversible.
-Considerese un sistema aislado que contenga 2 secciones separadas con gases a diferentes presiones. Al quitar la separacion ocurre un cambio altamente irreversible en el sistema al equilibrarse las dos presiones. Pero el mediono ha sufrido cambio durante este proceso, asi que su energia y su estado permanecen constantes, y como el cambio es irreversible la entropia del sistema a aumentado
Transferencia de entropia.
La entropia esta relacionada con la aleatoriedad del movimiento molecular (energia termica) , por esto, la entropia de un sistema no decrece si no hay cierta interaccion externa. Ocurre que la unica manrea que el hombre conoce de reducir la energia termica es transferirla en forma de calor a otro cuerpo, aumentando asi la energia termica del segundo cuerpo y por ende su entropia.
Por otro lado transfiriendo energia termica es posible reducir la entropia de un cuerpo. Si esta transferencia de energia es reversible, la energia total permanece constante, y si es irreversible la entropia aumenta.
De lo anterior se concluye que el calor es un flujo de entropia. En el caso de la transferencia de energia mecanica, i.e. fde trabajo, no hay un flujo directo de entropia.
Si la transferencia de energia mecanica en un sistema se realiza con irreversibilidad se producen aumentos de entropia en el sistema, es decir se generan entropia. Esta generacion de entropia trae consigo una perdida de trabajo utilizable debido a la degradacionde la energia mecanica producido por la irreversibilidades presentes como lo es el roce.

Irreversibilidad y entropia.
Ahora nos podriamos preguntar : De que depende la reversibilidad de un proceso??. Una respuesta a esto es decir que la variacion de entropia es el criterio que permite establecer el sentido en que se produciran un proceso determinado que cumpla con el primer principio de la termodinamica.
Asi, el ingeniero mecanico esta interesado en la reversibilidad y en las variaciones de entropia por que desde su punto de vista algo se ha «perdido» cuandoo se ha producido un prceso irreversible, en una maquina de vapor io en una turbina. Lo que se ha perdido, sin embargo, no es enrgia, sino una oprtunidad. La oprtunidad de transformar energia termica en energia mecanica. Puesto que la energia interna de una sustancia que evoluciona en una maquina termica se recupera generalmente por absorcion del calor, decimos que lo que se pierde es una oprtunidad de converretir calor en trabajo mecanico.
Es imposible extraer calor de una unica fuente y hacer funcionar una maquina ciclica; en cambio podriamos hacer hacer funcionar una maquina etre dos fuentes, una caliente y otra fria, extrayendo calor de una y entregandosela a la otra, y disponiendo de una parte de ese calor para producir trabajo mecanico. Una vez que las fuentes han alcanzado la misma temperatura, esta oprtunidad esta irremediablemente perdida. Por lo tanto cualquier proceso irreversible en una maquina termica disminuye su rendimiento, es decir, reduce la cantidad de trabajo mecanico que puede obtenerse con una cierta cantidad de calor absorbido por la sustancia que evoluciona.

Principio del aumento de entropia.
Todos los procesos reales son irreversibles. Se producen a una velocidad con diferencia s finitas de temperaturay de presionentre loa diferentes partes de un sistema o entre un sistema y el medio ambiente. En mecanica se introducen los conceptos de energia, cantidad de movimiento y otros por que se conservan. La entropia no se conserva , sin embargo, excepto en los procesos reversibles y esta propiedad no familiar, o falta de propiedad de la funcion entropia, es una razon del por que existe cierto misterio sobre el concepto de entropia. Cuando se mezcla un vaso de agua caliente con uno de agua fria, el calor entregado por el agu caliente es igual al recibido por el agua fria, sin embargo la entropia del agua caliente disminuye y la del agua fria aumenta; pero el aumento es mayor quer la disminucion por lo que la entropia total del sistema aumenta. De donde ha salido esta entropia adicional?. La respusta es que ha sido creada durante el proceso de mezcla. Por otra parte, una vez que fue creada, la entropia no puede seer destruida. El universo debe cargar con este aumento de entropia.
«La energia no puede sera creada ni destruida»,nos dice el primer principio de la termodinamica. » La entropia no puede ser destruida, pero puede ser creada», nos dice el segundo principio.
Calculo de variaciones de entropia.
Proceso isotermico: Como la temperatuar es constante se saca fuera de la integral y quedaria:
S2 – S1 =q / T
Proceso adiabatico: En un proceso adiabatico como no existe transferencia de calor la variacion de entropias es cero.
